撰文 | 十一月
责编 | 兮
细胞命运的转变常常伴随着细胞形状和机械力的改变。然而,细胞机械力如何影响信号通路进而控制细胞命运。
为了探究形状、机械力和命运之间的相互作用,近日,德国欧洲分子生物学实验室Alba Diz-Munoz研究组发文题为Cell Surface Mechanics Gate Embryonic Stem Cell Differentiation,利用生物物理方法对干细胞分化过程中细胞表面力学的作用进行了研究。

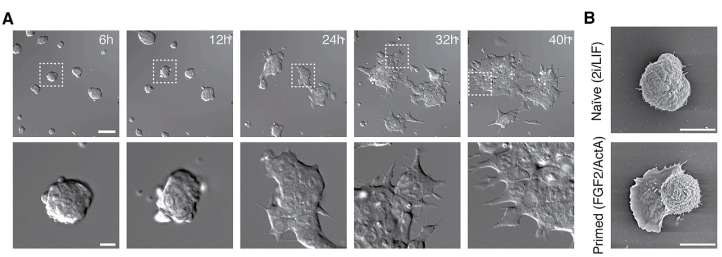
在大多数多细胞生物的发育过程中,全能干细胞的形状为球形,而全能细胞分化产生的细胞的形态在成体中呈现出显著的不同。命运的获得和细胞形状的变化往往同时出现。而细胞形状是由表面力学和与细胞外环境的相互作用决定的。但是一直以来细胞内在的机械力特征与命运调节之间的机制还不得而知。其中有一个非常有趣的例子便是小鼠的胚胎干细胞的早期分化过程(图1)。Naïve(原始态)的干细胞生长成致密群落,在有2i/LF的情况下保持naïve的状态。而在移除2i/LF这个分化的阻碍物之后,naïve的干细胞逐渐快速地“摊平”,成为单层的primed(始发态)状态的细胞(图1)。这种细胞平展的状态对于干细胞退出naïve状态非常关键,如果naïve的干细胞被培养在柔软的基质上,这些细胞不能平展,将不能分化成primed状态【1】。
为了评估细胞表面张力是否以及如何调节细胞命运的,作者们首先通过单细胞原子力显微镜(Single-cell atomic force spectroscopy)静态牵引测量表面膜张力。作者们发现,与naïve细胞相比,primed细胞的膜破裂所需要的牵引力显著降低。表面的静态牵引拉力的测量可能涉及到两方面,一是平面内膜张力(In-plane membrane tension),另一方面是MCA(Membrane-to-cortex attachment)【2,3】。为了确定这两个力学参数在干细胞分化过程中发生了哪些变化,作者们使用通过动态牵引的方式来测量MCA。作者们发现,naïve小鼠胚胎干细胞中的MCA比primed状态要高出3倍。作者们确认,MCA的变化是一种细胞分化过程中的自主特性,在脱离naïve状态的过程中,小鼠胚胎干细胞特异性减少了质膜与皮层肌动蛋白之间的粘附或者连接作用。
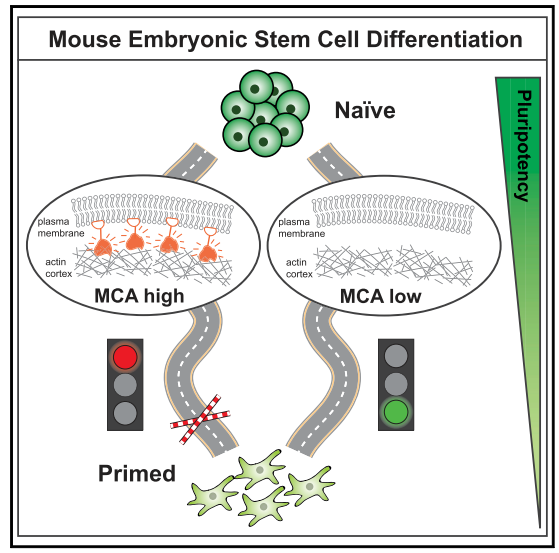
但MCA的变化与胚胎干细胞命运的变化谁是因谁是果呢?为了揭开这一问题的答案,作者们比表达了组成性激活的Ezrin蛋白,Erzin是连接质膜到皮层的蛋白,组成性激活的Ezrin是目前实验中增加MCA的金标准【4,5】。作者们发现,在表达组成性激活的Ezrin之后发现胚胎干细胞可以维持和naïve细胞中类似的高MCA。进一步地,作者们想要检测Ezrin生化功能是否参与调控MCA对于naïve多能性细胞退出,作者们建立一个iMC linker的实验系统,该系统能够直接连接质膜到肌动蛋白上,但是使得识别信号途径被惰性化。作者们发现,维持高MCA状态会促使干细胞维持naïve的细胞状态。但是通过MCA的降低实验,作者们发现MCA的降低是促进naïve-to-primed细胞状态转化的必要但是非充分条件。这些结果说明,在naïve状态的退出过程中,MCA的高低是作为门控而非驱动因素发挥作用的(图2)。
值得一提的是, 英国剑桥大学Kevin J. Chalut研究组以及英国伦敦大学学院Ewa K. Paluch研究组合作在当期Cell Stem Cell上发表背靠背文章,题为Membrane Tension Gates ERK-Mediated Regulation of Pluripotent Cell Fate,发现膜张力门控增加内吞作用会作为一个关键机制调节ERK调控的细胞命运转变。

作者们发现细胞形状的改变是由β-catenin介导的RhoA活性的降低以及随后质膜张力的降低所调节的。而且,阻止膜张力的降低会胚胎干细胞以及类原肠胚早期分化的缺陷。膜张力的降低促进了FGF信号成分的内吞,从而激活ERK信号并引导其从胚胎干细胞状态退出。而增加Rab5a促进的内吞作用可以挽救缺陷的早期分化。
总的来说,两篇工作均证明机械力对于胚胎干细胞分化过程的重要调节作用,对于理解细胞机制如何调控生化信号和细胞命运具有根本的重要性。
原文链接
https://doi.org/10.1016/j.stem.2020.10.017
https://doi.org/10.1016/j.stem.2020.10.018
参考文献
1 Chowdhury,F. et al. Soft substrates promotehomogeneous self-renewal of embryonic stem cells via downregulating cell-matrixtractions. PloS one5, e15655,doi:10.1371/journal.pone.0015655 (2010).
2 Brochard-Wyart, F., Borghi, N., Cuvelier, D. &Nassoy, P. Hydrodynamic narrowing of tubes extruded from cells. Proceedings of the National Academy ofSciences of the United States of America103, 7660-7663, doi:10.1073/pnas.0602012103 (2006).
3 Hochmuth, F. M., Shao, J. Y., Dai, J. &Sheetz, M. P. Deformation and flow of membrane into tethers extracted fromneuronal growth cones. Biophysicaljournal70, 358-369,doi:10.1016/s0006-3495(96)79577-2 (1996).
4 Liu, Y. etal. Constitutively active ezrin increases membrane tension, slowsmigration, and impedes endothelial transmigration of lymphocytes in vivo inmice. Blood119, 445-453, doi:10.1182/blood-2011-07-368860 (2012).
5 Stefani, C.et al. Ezrin enhances line tension along transcellular tunnel edges viaNMIIa driven actomyosin cable formation. Naturecommunications8, 15839,doi:10.1038/ncomms15839 (2017).
